Escenario clínico
En la guardia del hospital recibes una llamada al busca, la enfermera de planta solicita valoración de una niña que presenta fiebre elevada. Se trata de una niña de 13 años, con infección respiratoria por coronavirus que ha ingresado ese mismo día. Revisas la historia, la niña acudió a urgencias por fiebre de dos días de evolución (temperatura máxima 38,8 °C) junto con tos productiva, sensación de disnea leve y odinofagia sin otros síntomas asociados. No refieren contactos conocidos con coronavirus SARS-CoV-2. En urgencias presenta temperatura de 38,8 °C, frecuencia respiratoria de 28 respiraciones por minuto (rpm), saturación de oxígeno de 92%, frecuencia cardiaca de 102 latidos por minuto y presión arterial sin alteraciones.
En la exploración se constata triángulo de evaluación pediátrica estable, sin tiraje a ningún nivel, auscultación pulmonar con murmullo vesicular conservado y crepitantes en base izquierda, sin otras alteraciones. Se realizó analítica sanguínea con hemocultivo (no muestra linfopenia, elevación de LDH, ni otros marcadores de inflamación positivos), frotis nasal que resulta positivo para el nuevo coronavirus (SARS-CoV-2) y radiografía de tórax, que muestra un broncograma aéreo retrocardiaco y borramiento perihiliar. Ingresó en hospitalización en aislamiento, con oxigenoterapia a 1 litro por minuto (lpm) en gafas nasales y antitérmicos orales. La paciente, durante su ingreso, ha presentado buena tolerancia oral, sin síntomas digestivos, mantiene oxigenoterapia a 1,5 lpm en gafas nasales con saturaciones de oxígeno del 96%. Entras a valorarla a su habitación, presenta 39,8 °C, frecuencia respiratoria 29 rpm, mantiene una exploración similar a la del ingreso, sin dificultad respiratoria y una auscultación pulmonar con crepitantes en base izquierda sin otras alteraciones. La enfermera te plantea si además de pautarla antitérmicos más frecuentemente, no sería conveniente tratar también con corticoides, como ha visto que han hecho en las plantas COVID de adultos.
Pregunta clínica estructurada (PICO)
En niños con COVID-19 con clínica respiratoria, ¿es adecuado iniciar tratamiento con corticoides?
Búsqueda y evaluación de la evidencia
Fecha de formulación: 23 enero 2021.
Para esta revisión buscamos estudios sobre uso de corticoides con medidas de efecto clínicas, de cualquier diseño, para población pediátrica y ensayos clínicos aleatorizados (ECA), para cualquier grupo de edad.
Realizamos una búsqueda por dos revisores independientes en las siguientes bases de datos: MEDLINE, Trip Database, Embase y Cochrane Register of Controlled Trials (CENTRAL) con los términos descritos en tabla 1. Se amplió el estudio por revisión manual de las referencias bibliográficas de los estudios identificados.
Tabla 1. Búsqueda bibliográfica. Mostrar/ocultar
|
PubMed |
((wuhan[All Fields] AND ("coronavirus"[MeSH Terms] OR "coronavirus"[All Fields])) AND 2019/12[PDAT]: 2030[PDAT]) OR 2019-nCoV[All Fields] OR 2019nCoV[All Fields] OR COVID-19[All Fields] OR SARS-CoV-2[All Fields])
AND (("clinical"[Title/Abstract] AND "trial"[Title/Abstract]) OR "clinical trials as topic"[MeSH Terms] OR "clinical trial"[Publication Type] OR "random*"[Title/Abstract] OR "random allocation"[MeSH Terms] OR "therapeutic use"[MeSH Subheading])
AND ("Steroids"[Mesh] OR "Dexamethasone"[Mesh] OR “Hydrocortisone"[Mesh] OR "Methylprednisolone"[Mesh])
AND (Clinical Trial[ptyp] OR Meta-Analysis[ptyp] OR Randomized Controlled Trial[ptyp] OR systematic[sb]) |
|
Embase |
(coronavirus AND disease AND 2019 OR 'coronavirus disease 2019' OR 'sars-related coronavirus'/exp OR 'sars-related coronavirus') AND ([cochrane review]/lim OR [systematic review]/lim OR [meta analysis]/lim OR [controlled clinical trial]/lim OR [randomized controlled trial]/lim) AND ([newborn]/lim OR [infant]/lim OR [child]/lim OR [preschool]/lim OR [school]/lim OR [adolescent]/lim) AND [embase]/lim AND 'corticosteroid'/dd |
|
Trip Database |
((covid) OR (covid-19) OR (SARS-CoV-2)) AND treatment AND child |
|
Cochrane |
(covid):ti,ab,kw OR (covid-19):ti,ab,kw OR (SARS-CoV-2):ti,ab,kw |
De los trabajos seleccionados hicimos una segunda valoración con lectura del título y resumen del artículo, en algunos casos el artículo completo. Excluimos los ensayos que no fueran aleatorizados, incluyéndose los de adultos, ya que solo un estudio incluía menores de 18 años (figura 1). Finalmente seleccionamos 10 artículos (9 ECA1-9 y 1 revisión sistemática [RS])10.
Figura 1. Diagrama de flujo de la selección de estudios. Mostrar/ocultar
Elaboramos tablas resumen de evidencia con los datos extraídos de los trabajos revisados (tabla 2). Evaluamos la calidad de la evidencia siguiendo la metodología GRADE, valorando el riesgo de sesgos de los ECA con la herramienta RoB-2 (Risk of Bias) de la Colaboración Cochrane (tabla 3), la consistencia de los resultados, la relación directa con el escenario clínico, la precisión, el tamaño del efecto, la relación dosis-respuesta, el sesgo de publicación, el control de factores de confusión, la importancia de la medida de resultado y su relación coste-beneficio. Utilizamos el programa de la Colaboración Cochrane Review Manager 5.3 para el metanálisis, siguiendo modelos de efectos aleatorios.
Tabla 2. Datos extraídos de los trabajos revisados. Mostrar/ocultar
|
Estudio
Diseño
|
Muestra
|
Intervención/exposición
Comparación
|
Medidas de resultado
Resultados
|
Comentarios
|
|
Autor y año: Horby 2020
RECOVERY5
País: Reino Unido
Diseño: ensayo clínico aleatorizado multicéntrico
|
CI: COVID-19 confirmado o sospechado ingresados (se quita limitación edad mayor de 18 años a mitad del proceso reclutamiento)
CE: historia médica que a juicio del médico del paciente pudiera ponerle en riesgo si participaba en estudio 2020
|
GI: dexametasona (DXM) oral/i.v., 6 mg diarios, 10 días o hasta el alta hospitalaria, además del tratamiento usual
n = 2104
GC: tratamiento usual
n = 4321 pacientes
|
MP
Mortalidad por todas las causas a los 28 días:
22,9% GI frente a 25,7% GC
RR: 0,83 (IC 95:0,75 a 0,93)
Con ventilación mecánica (VM):
95/324 (29.3%) GI frente a 283/683 (41.4%) GC
RR: 0,64 (IC 95:0,51 a 0,81). NNT: 7*
Solo con oxígeno: RR: 0,82 (IC 95: 0,72 a 0,94). NNT 22*
Sin oxígeno: RR: 1,19 (IC 95: 0,91 a 1,55)
Otras medidas:
Alta antes de 28 días RR: 1,10 (IC 95: 1,03 a 1,17)
Progresión a VM o muerte: RR: 0,92 (IC 95: 0,84 a 1,01)
|
Principal conclusión: en población general adulta la mortalidad por todas las causas se redujo
En pacientes con afectación respiratoria grave (necesidad de VM u oxigenoterapia) menor mortalidad (bajo riesgo de sesgo, resultado preciso, en un desenlace relevante)
En pacientes sin necesidad de oxigenoterapia el resultado no fue concluyente (bajo riesgo de sesgo, resultado impreciso, desenlace relevante)
Limitaciones (sesgos): no incluye niños, límite inferior de edad 51,5 años
|
|
Autor y año: Corral-Gudino 20202
GLUCOCOVID
País: España
Diseño: ensayo clínico parcialmente aleatorizado multicéntrico, (abierto)
|
CI: adultos con COVID-19 moderado-grave (neumonía con riesgo de desarrollar SARS)
CE: intubados, VM o en CI, nefropatía en diálisis, embarazada, tratamiento con corticoides o inmunosupresores
Muestra estimada 180 pacientes
|
GI: metilprednisolona oral 40 mg c/12 h (3 días), 20 mg c/12 h (3 días)
GI1: adjudicado inicialmente por preferencia médico n=22
GI2: asignado por aleatorización n=34
GC: tratamiento usual (n = 29)
n = 90
|
MP Combinación (Mortalidad, necesidad de ingreso en UCI o VM invasiva)
Análisis por protocolo (alcanza significación)
RR: 0,50 (IC 95: 0,27-0,94)
Análisis por intención de tratar, ajustado por edad
RR: 0,55 (IC 95: 0,33-0,91)
Mortalidad
Datos por protocolo
GI1 + GI2 9/49 (no datos diferenciados)
GC 5/29
|
Principal conclusión: efecto beneficioso en la evolución clínica de pacientes con COVID-19 grave
Limitaciones (sesgos): datos preliminares de estudio en curso, mitad pacientes reclutados
Se aleatoriza solo una parte de muestra reclutada
No grupo control, ensayo abierto
Sin datos diferenciados gravedad/ ni mortalidad según nivel gravedad/tipo asistencia respiratoria utilizada
|
|
Autor y año: Responsible Party:
Peking Union medical College Hospital 2020
Steroids SARI1
País: China
Diseño: ensayo clínico aleatorizado muticéntrico (abierto)
|
CI: adultos con COVID-19 confirmado (>7 días evolución), que precisan UCI, paO2/FiO2 <200, VM (invasiva/ no invasiva/o OAF mayor 45 l/min)
CE: embarazo, contraindicación uso de corticoides, administración previa de CC, enfermdad grave previa (pulmonar/oncológica terminal), Evento grave previo a ingreso UCI (por ejemplo, fallo cardiaco)
Muestra estimada: n = 80
|
GI: metilprednisolona i. v.
40 mg cada 12 horas. (5 días)
GC: tratamiento usual
(datos obtenidos RS React)
GI n = 24 (61 a 74 años)
GC n = 23 pacientes (54 a 68 años)
|
MP
Puntuación daño pulmonar Lower Murray
MS Mortalidad a los 30 días:
(datos obtenidos RS React) Estudio finalizado, datos no publicados
13/24 GI frente a 13/23 GC.
OR: 0,91 (IC 95:0,29 a 2,87).
|
Principal conclusión: sin publicación resultados
Limitaciones (sesgos): finalización precoz
|
|
Autor y año: Jeronimo 20206
Metcovid
País: Brasil
Diseño: ensayo clínico aleatorizado
|
CI: mayores 18 años, hospitalizados con sospecha clínica o radiológica y síntomas respiratorios con saturación basal <94%, oxigenoterapia o VM invasiva
CE: alergia, embarazo/ lactancia, convivencia con inmunodeprimido, tratamiento previo con corticoides o inmunosupresores, insuficiencia renal crónica o cirrosis descompensada.
Muestra estimada: n = 416
|
GI: metilprednisolona i.v.
0,5 mg/kg cada 12 horas (5 días)
GC: placebo
GI n = 209 (50 a 68 años)
GC n = 207 pacientes (56 a 72 años)
|
MP
Mortalidad a los 28 días:
(PAC por intención de tratar)
72/194 GI frente a 76/199 GC
HR: 0,92 (IC 95: 0,66 a 1,27)
MS
Ventilación mecánica
58/71 GI frente a 60/70 GC
OR: 0,74 (IC 95:0,36 a 1,82) (*)
|
Principal conclusión: en pacientes hospitalizados con COVID-19, un curso corto de metilprednisolona no redujo la mortalidad en la población estudiada.
Solo se encontró menor mortalidad en mayores de 60 años
Limitaciones (sesgos): diagnóstico clínico y radiológico. Muestra pequeña para valoración análisis por subgrupos. Realizado en un único centro/centro de referencia: muestra con mortalidad elevada, inicio de tratamiento en algunos pacientes con enfermedad avanzada
|
|
Autor y año: Villar 20209
DEXACOVID network
País: España
Diseño: ensayo clínico aleatorizado de superioridad multicéntrico (abierto)
|
CI: adultos con COVID-19 confirmado, VM, diagnóstico de SARS moderado-grave
CE: embarazo, participación en otro estudio, tratamiento previo con corticoides, valoración de médico responsable de que participación no sería en mejor interés paciente.
Muestra estimada: n = 200 (ensayo registrado marzo 2020, suspendido)
|
GI: dexametasona (DXM) i.v., 20 mg diarios, (5 días), 10 mg diarios (5 días)
GC: tratamiento usual
(datos obtenidos de RS React) GI: n = 7 (48 a 68 años)
GC: n = 12 pacientes (52 a 69 años)
|
MP
Mortalidad a los 60 días
MS
Mortalidad a los 28 días
(datos obtenidos de RS React)
2/7 GI frente a 2/12 GC
OR: 2 (IC 95: 0,21 a 18,69)
|
Principal conclusión: sin publicación resultados
Limitaciones (sesgos): finalización precoz
|
|
Autor y año: Tomazini 20208
CoDEX
País: Brasil
Diseño: ensayo clínico aleatorizado multicéntrico (abierto)
|
CI: mayores de 18 años con COVID-19 (confirmada o sospechada), precisan VM, SARS moderado-grave ingresado en UCI
CE: embarazo, lactancia, uso previo corticoides, inmunosupresores, quimioterapia, neutropenia por patología hematooncológica, muerte esperada en siguientes 24 horas
Muestra estimada: n = 350 (finalizado 21 julio)
|
GI: dexametasona (DXM) i.v., 20 mg diarios, (5 días), 10 mg diarios (5 días)
GC: tratamiento usual
(21 julio, finalizado ensayo)
GI: n = 151 pacientes
GC: n = 148 pacientes
|
MP
Días libre soporte VM (vivo y sin VM) durante primeros 28 días fue mayor en GI
6.6 (IC 95: 5,0 a 8.2) frente a 4 (IC 95: 2,9 a 5,4)
DM: (ajustada edad, necesidad oxigeno)
2,26 (IC 95: 0,2 a 4,38) P = 0,04)
MS
Mortalidad, escala gravedad a 15 días, escala SOFA, duración estancia UCI/VM
Mortalidad por todas las causas a los 28 días
85/151 GI frente a 91/148 GC.
OR: 0,86 (IC 95:0,64 a 1,15).
|
Principal conclusión: dexametasona en pacientes con COVID-19 y SARS grave moderado aumenta los días de pacientes vivos sin VM, sin diferencias en mortalidad por todas las causas
Limitaciones (sesgos): finalización precoz
No grupo control, ensayo abierto
|
|
Autor y año: Dequin 20203
CAPE
País: Francia
Diseño: ensayo clínico aleatorizado multicéntrico
|
CI: mayores de 18 años con COVID-19 (confirmada o sospechada) ingresado en UCI con fallo respiratorio agudo de 24-48 horas evolución (mínimo 10 lpm oxigenoterapia)
CE: shock séptico, orden de no intubación
Muestra estimada: n = 290 (finalizado 29 junio)
|
GI: hidrocortisona
Infusión continua 8 o 14 días
(200 mg/d (4 o 7 días) (100 mg/d (2 o 4 d) (50 mg/d) (2 o 3 d)
n = 76 (52 a 71 años)
GC: placebo
n = 73 pacientes
|
MP
Fallo de tratamiento a los 21 días (muerte o requerimiento de VM o OAF)
32/76 GI frente a 37/73 GC, sin diferencias
Mortalidad a los 21 días: sin diferencias
11/75 GI frente a 20/73 GC
OR: 0,46 (IC 95: 0,20 a 1,04)
|
Principal conclusión: dexametasona en pacientes con COVID-19 grave y fallo respiratorio, no disminuyó significativamente fallo de tratamiento en día 21 (muerte o soporte respiratorio mantenido)
Limitaciones (sesgos): finalización precoz, estudio sin potencia para detectar diferencias
|
|
Autor y año: Responsible party Scandinavian Critical Care Trials Group 20204
COVID STEROID
País: Dinamarca
Diseño: ensayo clínico aleatorizado muticéntrico
|
CI: mayores de 18 años, ingresados por COVID-19 confirmado con VM/ VMNI u oxigenoterapia a más de 10 lpm por cualquier dispositivo
CE: alergia, embarazo, infección fúngica invasiva, uso de corticoides previos, VM las 48 horas previas en caso de decisión previa de no uso de ventilación mecánica invasiva
Muestra estimada: n = 1000
|
GI: hidrocortisona
Infusión continua o bolo cada 6 horas (200 mg/d (7 días)
GC: placebo (datos obtenidos de RS React)
n = 15 (52 a 75 años)
n = 14 pacientes (55 a 71 años)
|
MP
Días sin mortalidad sin soporte vital a los 28 días
MS
Mortalidad/ días sin mortalidad ni soporte vital a los 90 días. Mortalidad y calidad de vida al año.
Mortalidad a los 28 días:
6/15 GI frente a 2/14 GC
OR: 4 (IC 95: 0,65 a 24,66)
|
Principal conclusión: sin publicación datos
Limitaciones (sesgos): activo/sin reclutamiento (clinicaltrials.gov)
Última actualización publicada 7 septiembre, 2020
|
|
Autor y año: REMAP CAP 20207
REMAP
País: 8 países (Europa, Norte américa, Australia) 121 centros (113 brazo corticoide)
Diseño: ensayo clínico aleatorizado multicéntrico (abierto)
|
CI mayores de 18 años con COVID-19 (diagnóstico clínico o confirmación microbiológica) ingresados en UCI por fallo respiratorio o cardiovascular grave
CE muerte inminente, alergia, uso corticoide previo, más de 36 horas tras ingreso UCIP
9 marzo a 17 junio, finalización precoz (por resultados otro estudio) seguimiento hasta 12 agosto 2020
Muestra estimada: n = 500/1000
|
GI hidrocortisona (N = 384) (edad media 60 años, 48 a 72 años)
GI1 Dosis fija: 50 o 100 mg cada 6 horas, 7 días (n = 137)
GI2 dosis shock: 50 mg cada 6 horas con aparición shock clínico (n = 141)
GC tratamiento habitual sin hidrocortisona (n = 101)
|
MP
Días sin mortalidad ni soporte respiratorio/ cardiovascular en UCIP (a los 21 días) 93% y 80% superioridad GI1 y GI2 frente a GC
GI1 0 (RI -1 a 15)
GI2 0 (RI -1 a 13)
GC 0 (RI -1 a 11)
MS: duración estancia en UCIP/hospital, días sin soporte respiratorio o cardiovascular
Mortalidad 54% y 62% superioridad GI1 y GI2 frente a GC.
GI1 41/137; GI2 37/141; GC 33/99
Mortalidad por todas las causas a los 21 días
OR: 0,71 (IC 95: 0,38 a 1,33)
|
Principal conclusión: hidrocortisona (dosis fija o dependiente situación shock) en pacientes con COVID-19 grave se mostró superior en cuanto a necesidad de días libres de soporte valorado a los 21 días
Limitaciones (sesgos): finalización precoz, no se alcanzaron valores superioridad establecidos
No grupo control, ensayo abierto
|
|
Autor y año: WHO React Working Group 202010
País: multicéntrico (Europa, Australia, América y Asia)
Diseño: revisión sistemática prospectiva y metaanálisis
|
CI: ECA evalúan eficacia y seguridad de corticoides en pacientes con COVID-19 grave
CE:
Bases de datos: Clinical Trials Gov, EU Clinica Trials register, Chinese Clinical Trial Registry, expertos grupo de trabajo de la OMS sobre terapia para COVID-19 (31 diciembre 2019 a 6 abril 2020)
Estudios: 7 ECA, realizados entre 26 febrero y 9 junio 2020 (datos de pacientes aleatorizados a 9 junio 2020) (1703 pacientes, edad media 60 años)
|
GI: 678 corticoides (Dexametasona, hidrocortisona, metilprednisolona)
GC: 1025 placebo o tratamiento habitual
|
MP Mortalidad a los 28 días (1 estudio a 21 días/1 estudio a 30 días)
GI: 222/678 (32,7%) GC: 425/1025 (41,4%)
OR: 0,66 (IC 95: 0,53 a 0.82) (Modelo efectos fijos)
*DM: DEXA-COVID-19; CoDEX; RECOVERY
OR: 0,64 (IC 95: 0,50 a 0, 82)
*HC: OR: 0, 69 (IC 95: 0,43 a 1,12)
CAPE COVID, COVID STEROID, REMAP-CAP
*Metilprednisolona: Steroids-SARI: OR 0, 91 (IC 95: 0,29 a 2,87)
Análisis por subgrupos:
Resultados similares según necesidad o no de Ventilación mecánica en momento aleatorización, sexo o ser mayor o menor 60 años.
Mayor asociación con disminución de mortalidad de CC en pacientes sin soporte vasoactivo.
Modificación final añadiendo un trabajo posterior (prácticamente sin cambios)
*Metilprednisolona: MetCOVID: OR: 0, 74 (IC 95: 0,30 a 1,83)
Resultado final mortalidad a 28 días
OR: 0,66 (IC 95: 0,54 a 0.82) (Modelo efectos fijos)
Seguridad
Efectos adversos serios con diferente definición entre estudios (reportados solo en 6 estudios)
GI 64/354; GC: 90/342
No parece que el riesgo de EA fuera superior, sin toxicidad específica
|
Principal conclusión: tratamiento con corticoides en pacientes con COVID-19 crítico (critically ill) reduce la mortalidad frente al uso de tratamiento habitual o placebo (calidad de evidencia moderada).
Limitaciones (sesgos): solo uno de los estudios considerado con “algún sesgo” por proceso aleatorización (metilprednisolona) con poco peso)
No posible valorar claramente EA
Diagnóstico de gravedad variable entre estudios.
No incluidos niños
|
CE: criterios de exclusión; CI: criterios de inclusión; DM: diferencia de medias; DT: desviación típica; EA: efectos adversos; ECA: ensayo clínico aleatorizado; GC: grupo control; GI: grupo intervención; IC 95: intervalo de confianza del 95%; MP: medida principal de efecto; N: tamaño muestral; NNT: número necesario a tratar; OR: odds ratio; Ro: riesgo basal (grupo control); RR: riesgo relativo; RS: revisión sistemática.
Tabla 3. Valoración de sesgos de los ensayos clínicos analizados. Escala RoB-2. Mostrar/ocultar
|
Estudios |
Proceso de aleatorización |
Desviación de intervenciones |
Resultados perdidos |
Sesgo en la medición de resultados |
Sesgos en los resultados informados |
Riesgo global |
Horby 20205
RECOVERY |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
|
Steroids-SARI1 |
Bajo |
Bajo |
FI |
Bajo |
FI |
Bajo |
Jerónimo 20206
METCOVID |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Villar 20209
DEXACOVID |
Bajo |
Bajo |
FI |
Bajo |
FI |
Bajo |
Tomazini 20208
CoDEX |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Dequin 20203
CAPE COVID |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
|
COVID STEROID4 |
Alguno |
Bajo |
Bajo |
Bajo |
Bajo |
Alguno |
|
REMAP7 |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Bajo |
Corral-Gudino 20202
GLUCOCOVID |
Alto |
Bajo |
Bajo |
Bajo |
Bajo |
Alto |
FI: falta información.
Resultados
Los ensayos clínicos encontrados han sido abiertos en su mayoría, dos de ellos adaptativos, que evalúan los resultados según un cronograma establecido y modifican los parámetros del protocolo del ensayo de acuerdo con las observaciones (REMAP-CAP7, Horby et al. [Recovery]5). También analizamos una revisión sistemática (RS) “viva”, del Grupo de Trabajo de Evaluación Rápida de Evidencias sobre Tratamientos de la COVID-19 (REACT) de la OMS10. Esta RS, pendiente de actualizar (Organización Mundial de la Salud, n. d.), incluyó datos de estudios no publicados y datos parciales de estudios que estaban en curso, por lo que parte de sus resultados no han sido considerados y se han utilizado los resultados finales publicados. Los corticoides estudiados han sido dexametasona, hidrocortisona y metilprednisolona. Solo un ECA planteaba la inclusión de pacientes pediátricos, el estudio RECOVERY5 (estudio abierto, pragmático), con datos preliminares publicados solo de pacientes adultos.
El nivel de gravedad y la necesidad de ventilación mecánica (VM) inicial de los ensayos clínicos fue variable. Cinco ECA incluían pacientes en unidades de cuidados intensivos (UCI), 3 ECA tenían pacientes hospitalizados con enfermedad moderada-grave o con afectación respiratoria (uno de ellos, Jerónimo et al.6, Metcovid, con información de subgrupos diferenciados, con VM, sin VM pero con oxigenoterapia o saturación de oxígeno ≤94% con aire ambiente) y, finalmente, un ECA, el de Horby et al.5, tenía tres subgrupos, uno sin soporte respiratorio, otro con oxigenoterapia (administrada a través de cualquier dispositivo/incluyendo ventilación no invasiva) y otro con VM. En los resultados analizados ha influido la publicación del estudio RECOVERY, el que mayor peso aporta a los análisis, que ha motivado la finalización prematura de otros estudios. La valoración de efectos adversos no ha sido bien detallada en algunos estudios y fue comunicada de forma diferente, lo que ha impedido unificar resultados, aunque los corticoides son fármacos utilizados hace tiempo, con dosis equivalentes conocidas y un perfil de seguridad en infecciones graves también conocido.
Comentario
La valoración del riesgo de sesgos global en la mayoría de los estudios fue baja. La mayoría son abiertos, aunque no hubo cegamiento completo, ello no condicionó la asignación, el proceso de aleatorización, ni debería haber influido en la valoración de algunas de las medidas de resultados evaluadas (mortalidad, necesidad de inicio de VM, días sin asistencia respiratoria). El riesgo de sesgo fue alto en un estudio porque incluía un grupo de pacientes asignados al tratamiento sin aleatorización previa (Corral-Gudino; GlucoCovid2), y con algún riesgo de sesgo, por limitaciones en el proceso de aleatorización, en otro (COVID STEROID4) (tabla 3).
Realizamos metanálisis por mortalidad, agrupando según los diferentes corticoides y niveles de gravedad (según el porcentaje de pacientes con VM a la inclusión) (figuras 2-4). Hicimos análisis de sensibilidad, descartando el estudio de Corral-Gudino (GlucoCovid)2, por incluir datos de pacientes no aleatorizados (probablemente los más graves, lo que iría en contra del corticoide), y el COVID-Steroid4, por riesgo de sesgo, aunque su exclusión no mostró cambios en los resultados. También realizamos análisis excluyendo subgrupos de pacientes leves sin necesidad de oxígeno, que sí mostró diferencias.
Figura 2. Forest-plot del metanálisis de mortalidad. Total y por tipo de corticoide. Mostrar/ocultar
Subestudios: Horby (RECOVERY)a (sin oxígeno); Horby (RECOVERY)b (oxígenoterapia o ventilación mecánica no invasiva; Horby (RECOVERY)c ventilación mecánica; METCOVID NoVM con SatO2 <94% u oxigenoterapia; METCOVID ventilación mecánica (VM)
2.1. Todos estudios incluidos
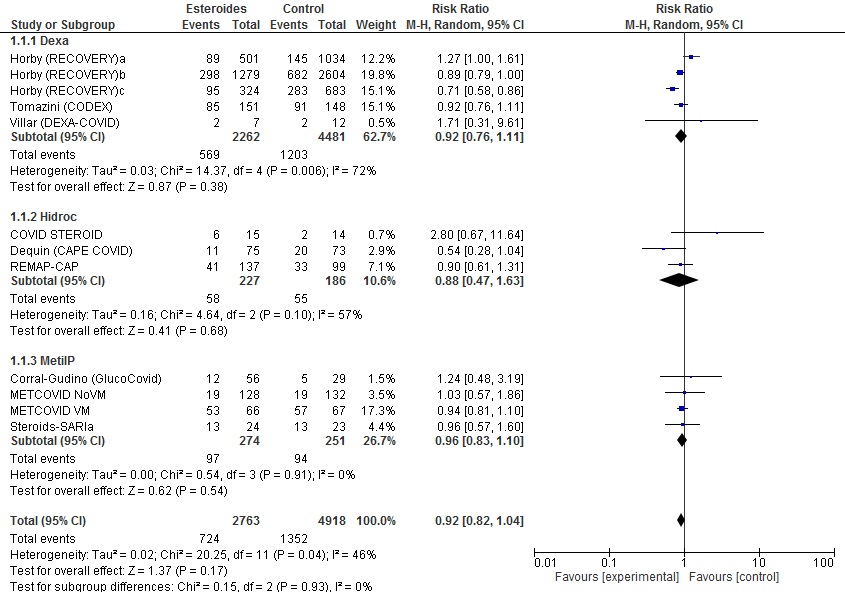
2.2. Descartando Horby (RECOVERY)a (único grupo sin gravedad respiratoria, sin necesidad de oxigenoterapia/soporte respiratorio/ingreso UCI)
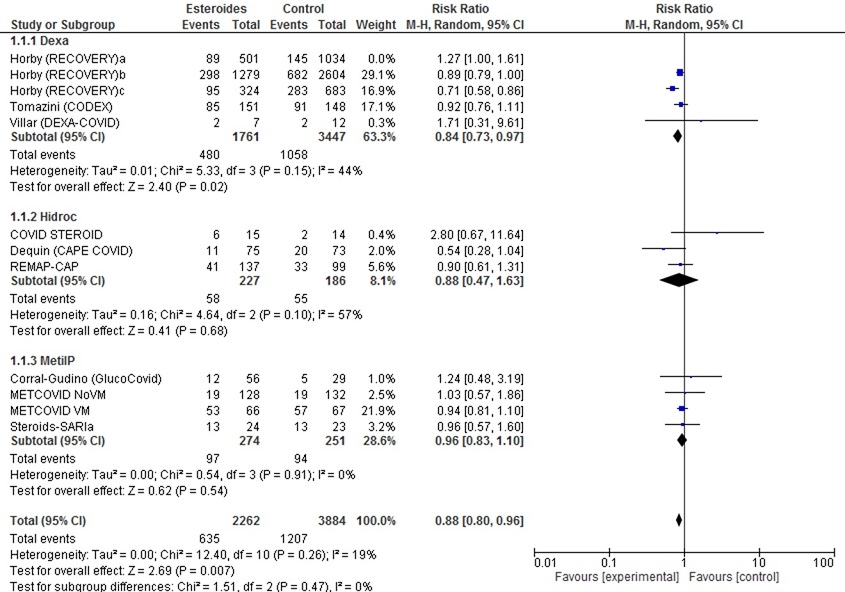
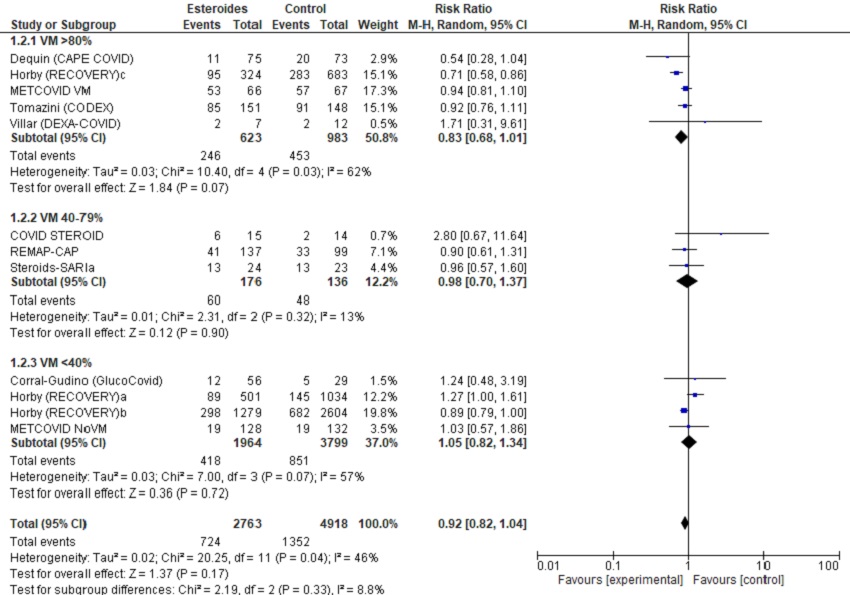
Figura 3. Forest-plot del metanálisis de mortalidad, según necesidad de ventilación mecánica inicial de la muestra. Mostrar/ocultar
Subestudios: Horby (RECOVERY)a (sin oxígeno); Horby (RECOVERY)b (oxígenoterapia o ventilación mecánica no invasiva; Horby (RECOVERY)c ventilación mecánica; METCOVID NoVM con SatO2<94% u oxigenoterapia; METCOVID ventilación mecánica (VM)
3.1. Todos estudios incluidos
3.2. Descartando Horby (RECOVERY)a (único grupo sin gravedad respiratoria, sin necesidad de oxigenoterapia/soporte respiratorio/ingreso UCI)
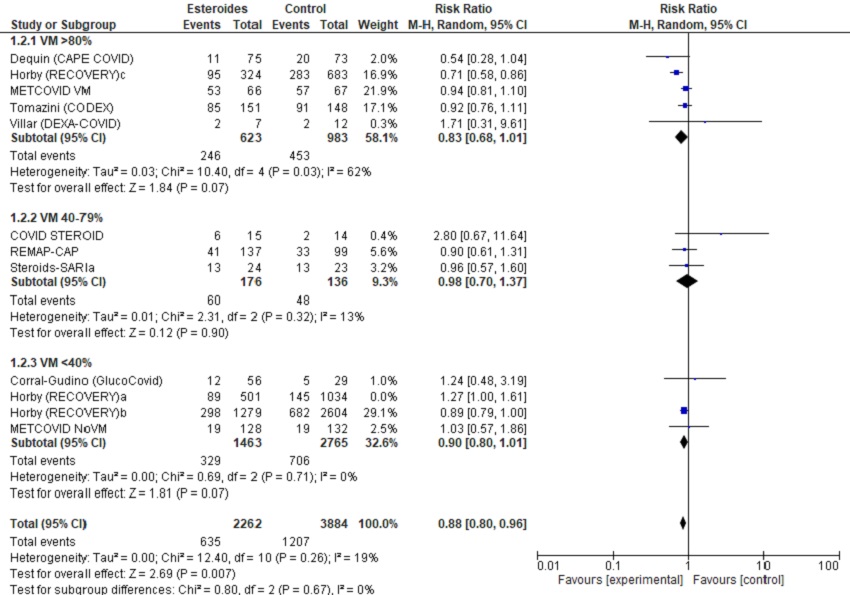
Figura 4. Forest-plot del metanálisis de inicio de ventilación mecánica. Mostrar/ocultar
En los análisis excluyendo los pacientes sin oxigenoterapia, los resultados son favorables para los corticoides. Encontramos eficacia en la mortalidad de forma global y, por subgrupos, en los estudios con dexametasona. También observamos beneficio en la medida de efecto necesidad de inicio de VM. En la tabla 4 presentamos la valoración GRADE de la evidencia.
Tabla 4. Valoración Grade. Intervención evaluada: corticoides frente a tratamiento convencional o placebo en COVID-19. Mostrar/ocultar
|
Resumen de resultados |
|
|
Limitaciones |
Efecto |
|
N.º de estudios |
Diseño |
Sesgos |
Inconsistencia |
Relación indirecta |
Imprecisión |
Otras |
N.º pacientes |
Riesgo basal |
Efecto relativo (IC 95) |
Efecto absoluto (IC 95) |
Calidad final |
Importancia |
|
Comparación: corticoides frente a tratamiento convencional o placebo |
|
Medida de resultado: mortalidad |
|
9 (12)a |
ECA |
|
-1 |
-1 |
|
|
7681 |
27,4% |
RR 0,92 (0,82 a 1,04) |
- |
Baja |
Crítica |
|
Medida de resultado: mortalidad, excluyendo grupos sin oxigenoterapia |
|
9 (11)b |
ECA |
|
|
-1 |
|
|
6146 |
31,0% |
RR 0,88 (0,80 a 0,96) |
NNT 27 (17 a 81) |
Moderada |
Crítica |
|
Medida de resultado: mortalidad, excluyendo grupos sin oxigenoterapia o de baja calidad |
|
7 (9)c |
ECA |
|
|
-1 |
|
|
6032 |
31,2 |
RR 0,87 (0,80 a 0,95) |
NNT 25 (17 a 65) |
Moderada |
Crítica |
|
Comparación: dexametasona frente a tratamiento convencional o placebo |
|
Medida de resultado: mortalidad |
|
3 (5) d |
ECA |
|
|
-1 |
|
|
6743 |
26,8% |
RR 0,92 (0,76 a 1,11) |
- |
Moderada |
Crítica |
|
Medida de resultado: mortalidad, excluyendo grupos sin oxigenoterapia |
|
3 (4)e |
ECA |
|
|
-1 |
|
|
5208 |
30,7,0% |
RR 0,84 (0,73 a 0,97) |
NNT 21 (13 a 109) |
Moderada |
Crítica |
|
Comparación: hidrocortisona frente a tratamiento convencional o placebo |
|
Medida de resultado: mortalidad |
|
3f |
ECA |
|
|
-1 |
-1 |
|
413 |
29,5% |
RR 0,88 (0,47 a 1,63) |
- |
Baja |
Crítica |
|
Comparación: metilprednisolona frente a tratamiento convencional o placebo |
|
Medida de resultado: mortalidad |
|
3 (4) g |
ECA |
|
|
-1 |
|
|
525 |
37,4% |
RR 0,96 (0,83 a 1,10) |
- |
Moderada |
Crítica |
|
|
|
5h |
ECA |
|
|
-1 |
|
|
1606 |
46,0% |
RR 0,83 (0,68 a 1,01) |
- |
Moderada |
Crítica |
|
Comparación: corticoides frente a tratamiento convencional o placebo en grupo con 40-79% con VM |
|
Medida de resultado: mortalidad |
|
3i |
ECA |
|
|
-1 |
-1 |
|
312 |
35,2% |
RR 0,98 (0,70 a 1,37) |
- |
Baja |
Crítica |
|
Comparación: corticoides frente a tratamiento convencional o placebo en grupo con <40% con VM |
|
Medida de resultado: mortalidad |
|
3 (4)j |
ECA |
|
|
-1 |
|
|
5763 |
22,4% |
RR 1,05 (0,82 a 1,34) |
- |
Moderada |
Crítica |
|
Medida de resultado: mortalidad, excluyendo grupos sin oxigenoterapia |
|
3k |
ECA |
|
|
-1 |
|
|
4228 |
25,5% |
RR 0,90 (0,80 a 1,01) |
- |
Moderada |
Crítica |
|
Comparación: corticoides frente a tratamiento convencional o placebo |
|
Medida de resultado: inicio de ventilación mecánica |
|
2 (3)l |
ECA |
|
|
-1 |
|
|
5567 |
8,1% |
RR 0,75 (0,61 a 0,92) |
NNT 50 (32 a 155) |
Moderada |
Importante |
RR: riesgo relativo; ECA: ensayo clínico aleatorizado; IC 95: intervalo de confianza del 95%; NNT: número necesario a tratar.
aHorby (RECOVERY)a, Horby (RECOVERY)b, Horby (RECOVERY)c, Tomazini (CODEX), Villar (DEXA-COVID), COVID STEROID, Dequin (CAPE COVID), REMAP-CAP, Corral-Gudino (GlucoCovid), METCOVID VM, METCOVID NoVM, Steroids-SARI. 9 ECA, uno de ellos Horby con 3 grupos, METCOVID con 2 grupos de pacientes diferenciados según necesidad de soporte respiratorio.
bHorby (RECOVERY)b, Horby (RECOVERY)c, Tomazini (CODEX), Villar (DEXA-COVID), COVID STEROID, Dequin (CAPE COVID), REMAP-CAP, Corral-Gudino (GlucoCovid), METCOVID VM, METCOVID NoVM, Steroids-SARI. 7 ECA, dos Horby y METCOVID con 2 grupos, otro de pacientes diferenciados según necesidad de soporte respiratorio. Excluidos 1 grupos: estudio Horby sin soporte respiratorio, Horby (RECOVERY)a.
cHorby (RECOVERY)b, Horby (RECOVERY)c, Tomazini (CODEX), Villar (DEXA-COVID), Dequin (CAPE COVID), REMAP-CAP, METCOVID VM, METCOVID NoVM, Steroids-SARI. 7 ECA, Horby y METCOVID con 2 grupos de pacientes diferenciados según necesidad de soporte respiratorio. Excluidos 3 grupos: estudio Horby sin soporte respiratorio- Horby (RECOVERY)a, COVID STEROID (por imprecisión), Corral-Gudino (GlucoCovid).
dHorby (RECOVERY)a, Horby (RECOVERY)b, Horby (RECOVERY)c, Tomazini (CODEX), Villar (DEXA-COVID).
e Horby (RECOVERY)b, Horby (RECOVERY)c, Tomazini (CODEX), Villar (DEXA-COVID).
f COVID STEROID, Dequin (CAPE COVID), REMAP-CAP.
g Corral-Gudino (GlucoCovid), METCOVID VM, METCOVID NoVM, Steroids-SARIa.
h Dequin (CAPE COVID), Horby (RECOVERY)c, METCOVID VM, Tomazini (CODEX), Villar (DEXA-COVID).
i COVID STEROID, REMAP-CAP, Steroids-SARIa.
j Corral-Gudino (GlucoCovid), METCOVID NoVM, Horby (RECOVERY)a, Horby (RECOVERY)b. 3 ECA, uno de ellos Horby con 2 grupos de pacientes diferenciados según necesidad de soporte respiratorio incluidos.
k Corral-Gudino (GlucoCovid), METCOVID NoVM, Horby (RECOVERY)b.
l Horby (RECOVERY)a, Horby (RECOVERY)b, (CAPE COVID), pacientes sin VM inicial. 2 ECA, uno de ellos Horby con 2 grupos de pacientes diferenciados según necesidad de soporte respiratorio incluidos.
Nota aclaratoria: para la elaboración del metanálisis, en los ensayos cuyos resultados no se publicaron, pero sí fueron facilitados para la elaboración de la RS WHO, se han utilizado dichos datos. En el resto de los ensayos incluidos, en vez de los resultados a fecha 9 junio de la RS, se han valorado los resultados de los ensayos publicados definitivamente. En el estudio REMAP se han utilizado los datos de pacientes tratados con dosis fija y no aquellos con dosis dependiente de la situación de shock.
Los resultados del metanálisis por mortalidad difieren en parte de los de la RS de la OMS, probablemente, porque la versión publicada no se ha actualizado todavía y no cuenta con los resultados finales de algunos estudios; nuestro metanálisis incluye un estudio más e incorpora grupos de pacientes con menor gravedad (sin oxígeno o soporte respiratorio bajo: Horbya, Horbyb, METCOVID NoVM). No se puede descartar la presencia de sesgos de publicación, ya que, como muestra el diagrama de embudo (figura 4), faltan estudios de pequeño tamaño en contra de corticoides, aunque es poco probable que movieran el efecto global. La heterogeneidad en la presentación de datos impide hacer estimaciones agrupadas de otras variables de progresión de gravedad, necesidad de soporte o tiempo de ingreso, aunque en medidas como días libres de soporte con VM o variables combinadas de mortalidad-necesidad de ingreso en UCI-VM los resultados también fueron favorables a los corticoides.
La calidad de la evidencia se consideró moderada, principalmente por ser indirecta (población adulta) y para algunas medidas baja por imprecisión o inconsistencia. La ausencia de enmascaramiento en los ECA, no se penalizó, por la objetividad de las medidas de efecto. Estas medidas se consideraron de importancia crítica para mortalidad e importante para ventilación mecánica. El uso de corticoides mostró beneficio global para mortalidad y reducción de ventilación mecánica. Los análisis por subgrupos solo permiten estimar efecto significativo para el uso de dexametasona; por grupos de gravedad, observamos mayor tendencia a favor en los pacientes graves, mayoritariamente con VM, y también en los leves, si excluimos los que no precisaron oxigenoterapia. Las diferencias entre tipos de corticoides (figura 5) parecen más debidas al peso del estudio de Horby5 en los análisis, que a diferencias reales.
Figura 5. Funnel-plot diagrama de bosque según tipo de corticoide. Mostrar/ocultar
La valoración de efectos adversos no ha sido bien detallada en algunos estudios y fue informada de forma diferente, lo que ha impedido unificar resultados, aunque los corticoides son fármacos utilizados hace tiempo, con dosis equivalentes conocidas y un perfil de seguridad en infecciones graves también conocido.
Como debilidades cabe destacar que el momento de evaluación, mortalidad a los 28 días, podría no ser suficiente, tanto para la medida de efecto como para evaluar la aparición de efectos adversos, ya que, por la gravedad de algunos pacientes con ingresos muy prolongados, la aparición de sobreinfecciones-sepsis u otros efectos adversos podría no haberse detectado. La definición de gravedad, mejor establecida actualmente, podría haber sido diferente en los ensayos, aunque el ámbito de realización de los estudios y el tipo de soporte respiratorio requerido inicialmente, bien detallados, ha permitido clasificar a los pacientes en un nivel de gravedad homogéneo.
En niños con COVID-19 la afectación respiratoria grave en general ha sido muy infrecuente, la mortalidad o el inicio de VM como medida de resultado podrían no ser las medidas más adecuadas en esta población. El perfil más alto de gravedad se ha visto en niños con síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2. En algunos estudios no está bien definida la influencia del uso de otros fármacos administrados concomitantemente; por ello, será importante valorar la posible interacción de los corticoides con fármacos inmunomoduladores o nuevos tratamientos que se vayan instaurando. En el estudio de Horby et al.5, 1707 posibles candidatos no fueron incluidos, el médico responsable podía valorar no incluir a un paciente sin criterios claros definidos y, aunque se cumplen los criterios de inclusión/exclusión, podría afectar a la generalización de resultados (impidiendo valorar beneficio en determinados perfiles clínicos de gravedad o tipo de paciente). Otro factor que podría afectar a la extrapolación de resultados es el nivel de mortalidad de cada muestra, que podría modificarse según mejora el manejo de la enfermedad con la curva de aprendizaje en el tiempo. En el MA, el mayor peso de un único estudio y la finalización prematura del resto de estudios por esos resultados podría condicionar también los resultados obtenidos. Los diferentes corticoides son fármacos con un perfil de seguridad conocido y se asume entre ellos un efecto similar a dosis equipotentes, aunque esto podría no ser así en el manejo de esta enfermedad11.
Considerando la importancia clínica de las medidas de efecto (mortalidad, VM), la calidad de la evidencia (“moderada-baja”), la magnitud del efecto (solo es significativa de forma global), y el carácter indirecto de la evidencia (estudios en adultos), realizamos una recomendación “débil” a favor del uso de corticoides en pacientes pediátricos con enfermedad respiratoria grave; la evidencia podría apoyar, también de forma débil, su uso en pacientes con enfermedad moderada, en base a la potencial reducción de la necesidad de ventilación mecánica.
Es previsible que estas recomendaciones deban revisarse por la publicación de estudios en población pediátrica12. Igualmente, la eficacia del uso de corticoides debe ser establecida en el tratamiento del síndrome inflamatorio multisistémico.
Resolución del escenario
En el caso que nos ocupa nuestro paciente presenta una neumonía por SARS-CoV-2 con hipoxemia bien controlada con oxigenoterapia (con una FiO2 a niveles bajos) sin precisar otro tipo de soporte respiratorio. La recomendación del uso de corticoides es para pacientes graves, mayoritariamente con ventilación mecánica y esta paciente no cumple ese criterio; la evidencia disponible actualmente se ha obtenido en pacientes adultos, que hasta ahora han mostrado, en general, una evolución de la enfermedad respiratoria más grave que en los niños. En base a una potencial reducción en la necesidad de inicio de ventilación mecánica podríamos plantearnos su uso, aunque la recomendación también es débil. Así que, apoyados por la evidencia actual, con la situación respiratoria de la niña (estable y con oxigenoterapia en escalón inicial) no prescribimos los corticoides.
Bibliografía
-
Marmor M, Jonas A. Corticosteroids therapy in adult patients with COVID-19 and ARDS (Steroids-SARI) trial Glucocorticoid Therapy for COVID-19 Critically Ill Patients With Severe Acute Respiratory Failure. Clinical Pulmonary Medicine. 2020;27:165-7.
-
Corral-Gudino L, Bahamonde A, de las Revillas FA, Gómez-Barquero J, Abadia-Otero J, García-Ibarbia C, et al. GLUCOCOVID: a controlled trial of methylprednisolone in adults hospitalized with COVID-19 pneumonia. Wien Klin Wochenschr. 2021:1-9.
-
Dequin PF, Heming N, Meziani F, Plantefève G, Voiriot G, Badié J, et al. Effect of Hydrocortisone on 21-Day Mortality or Respiratory Support Among Critically Ill Patients With COVID-19: A Randomized Clinical Trial. JAMA. 2020;324:1298-306.
-
Hydrocortisone for COVID-19 and Severe Hypoxia (COVID STEROID). En: Clinical Trials [en línea] [consultado el 09/03/2021]. Disponible en: https://clinicaltrials.gov/ct2/show/NCT04348305
-
RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021;384:693-704.
-
Jeronimo CMP, Farias MEL, Val FFA, Sampaio VS, Alexandre MAA, Melo GC, et al. Methylprednisolone as Adjunctive Therapy for Patients Hospitalized With COVID-19 (Metcovid): A Randomised, Double-Blind, Phase IIb, Placebo-Controlled Trial. Clin Infect Dis. 2020:ciaa1177.
-
The Writing Committee for the REMAP-CAP Investigators. Effect of Hydrocortisone on Mortality and Organ Support in Patients With Severe COVID-19: The REMAP-CAP COVID-19 Corticosteroid Domain Randomized Clinical Trial. JAMA. 2020;324:1317-29.
-
Tomazini BM, Maia IS, Cavalcanti AB, Berwanger O, Rosa RG, Veiga VC, et al. Effect of Dexamethasone on Days Alive and Ventilator-Free in Patients With Moderate or Severe Acute Respiratory Distress Syndrome and COVID-19: The CoDEX Randomized Clinical Trial. JAMA. 2020;324:1307-16.
-
Villar J, Añón JM, Ferrando C, Aguilar G, Muñoz T, Ferreres J, et al. Efficacy of dexamethasone treatment for patients with the acute respiratory distress syndrome caused by COVID-19: study protocol for a randomized controlled superiority trial. Trials. 2020;21:717.
-
The WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group. Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis. JAMA. 2020;324:1330-41.
-
Corticosteroides para el tratamiento de la COVID-19: orientaciones evolutivas, 2 de septiembre de 2020. En: Organización Mundial de la Salud [en línea] [consultado el 09/03/2021]. Disponible en: https://apps.who.int/iris/handle/10665/334338
-
Tendal B, Vogel JP, McDonald S, Norris S, Cumpston M, White H, et al. Weekly updates of national living evidence-based guidelines: methods for the Australian living guidelines for care of people with COVID-19. J Clin Epidemiol. 2020;131:11-21.
